Topología al servicio de las funciones biológicas
En una publicación reciente, el profesor Benjamín Loewe propone un mecanismo para explicar el origen simultáneo del orden nemático y hexático en células epiteliales, que se alinean y deforman cuando hay fricción intracelular.

Sus simulaciones revelan que la relación entre defectos hexáticos y nemáticos, que se colocalizan y pueden crear puntos críticos para generar apoptosis (muerte celular) y la posterior extrusión de esta, favoreciendo la regeneración y la homeostasis.
Comprender estos mecanismos subyacentes a la formación de patrones y al flujo en los tejidos biológicos es relevante en el estudio de la embriología y la generación de enfermedades.
Ordenamiento de las células epiteliales
El epitelio es un tipo de tejido que recubre los órganos así como las superficies externas del cuerpo, también delimita las cavidades internas y forma glándulas.
Las células epiteliales se organizan formando capas bidimensionales de una célula de grosor.
¿Cómo se mueven estas células? ¿Qué tipo de estreses enfrentan? ¿Qué propiedades geométricas tienen y cómo se deforman?
Estas preguntas fueron la base de un artículo publicado el año 2017 en la Revista Nature en el que se observó experimentalmente, y modeló computacionalmente de forma cuantitativa, células epiteliales, constatando que , pese a ser redondas, cuando están todas juntas en el tejido, se pueden deformar para alargarse y entonces colectivamente se ajustan para apuntar más o menos en el mismo sentido. Esto se llama orden nemático.
“Este orden nemático es llamativo, ya que generalmente se da en moléculas orgánicas bien largas, como en los cristales líquidos que están en las pantallas, y que naturalmente se alinean, pero no se esperaba encontrarlo en células con este tipo de geometría redonda. Otra cosa novedosa fue que el tejido hace uso de este orden para ejercer funciones biológicas, extrusión de células muertas”, explica el investigador Benjamín Loewe.
Un mecanismo de “limpieza celular”
Para que el cuerpo sobreviva y funcione adecuadamente se requiere de la homeostasis, un estado de equilibrio que obliga a la regeneración celular.
Para que esto suceda, existe el proceso de apoptosis, en el que se van eliminando del tejido células que ya no son necesarias.
¿Cómo se detona este proceso en las células epiteliales?
Parte de la clave está en el orden nemático. Este genera la alineación de las células, pero también produce defectos, que son puntos en el espacio en los cuales se pierde el orden orientacional. Los más comunes tienen una carga topológica con el valor -1/2 y +1/2.
Cuando surgen estos defectos lo hacen en pares para compensarse y por su forma, están topológicamente protegidos, por lo que no es posible eliminarlos, salvo superponiendo dos defectos de carga opuesta, aniquilándose mutuamente. Además, se comportan de forma similar a cargas eléctricas, por lo que si tienen una misma carga topológica se repelen y si es una carga diferente, se atraen.
Lo que se descubrió es que cuando aparecen estos defectos en los tejidos epiteliales, los que tienen una carga topológica +1/2 , generaban un mayor estrés en la zona, detonando la inducción de apoptosis, el proceso que lleva a la muerte de la célula y luego a su eliminación del tejido a través del proceso de extrusión. Este proceso que permite eliminar células del tejido es vital.

Dos órdenes que se potencian: nemático y hexático
A partir de la publicación en la Revista Nature, el investigador Benjamín Loewe y sus colaboradores se interesaron en estudiar este tipo de tejidos epiteliales, con el objetivo de entender y cuantificar cómo se forma esta topología.
Usando un modelo de campo de fase, en el cual cada célula está representada por un campo que toma un valor entre 0 (el valor que toma cuando se está ubicado fuera de la célula) y 1 (el valor que toma el campo en el interior de la célula). Entonces, al tener “n” células, hay “n” campos.
“En una primera etapa usamos este modelo para ver cómo se derretía el tejido a medida que hacíamos las células más o menos deformables o más móviles. También, lo usamos para hacer, por ejemplo, experimentos de microrreología, en los que poníamos una célula con el mismo campo pero más rígido, y sobre ella hacíamos fuerza para ver cómo se deforma y reacciona el material. Descubrimos que hay una fuerza mínima que se necesita para mover a esta célula más rígida a través del tejido. Lo interesante, es que constatamos que la velocidad de cada célula hace un balance de distintas fuerzas que actúan sobre ella”, explica el investigador.
La célula epitelial es un régimen donde las fuerzas viscosas son muchísimo más grandes que las fuerzas inerciales. Además, se ve afectada por la fuerza de fricción con el sustrato, la fuerzas que son producidas por otras células a su alrededor, la fuerza activa que surge de su capacidad de autopropulsión, entre otras.
Lo novedoso de esta publicación es que integró en los modelos la fuerza de fricción intracelular, por lo tanto, que ejercen las otras células alrededor.
“Si miráramos por un microscopio, veríamos que las células epiteliales quieren estar juntas y se enlazan entre sí. Al mover una contra la otra, si el movimiento es suficientemente lento, estos enlaces se tienden a romper y se libera energía en forma de calor. Nosotros nos propusimos simular cómo esta fricción afecta el orden nemático. Lo primero que hicimos fue hacer chocar dos células en las que su dirección no cambia en tres escenarios posibles, uno sin fricción, otro con fricción media y el último de fricción alta. Lo que constatamos es que en el primer escenario las células chocan y se alejan mucho más rápido, mientras que a mayor fricción, permanecen por más tiempo juntas ralentizando y arrestando la dinámica”, afirma el profesor Loewe.
Un segundo hallazgo destacado es que la fricción induce zonas de células que quieren ordenarse en una misma dirección, generando una dinámica colectiva de velocidades al interior del tejido.
Con esta información el equipo de investigadores modeló qué tan móviles son las células versus la fricción, midiendo la difusión efectiva y concluyeron que a mayor difusión, la célula se encuentra en un estado líquido, y a menor, en un estado sólido. Esto demostró que mientras más fricción tienes, necesitas mayor movimiento para poder “derretir” o deformar el tejido.
Luego, simularon el estado de las células en un sólido, un líquido y en la transición entre ambos estados.
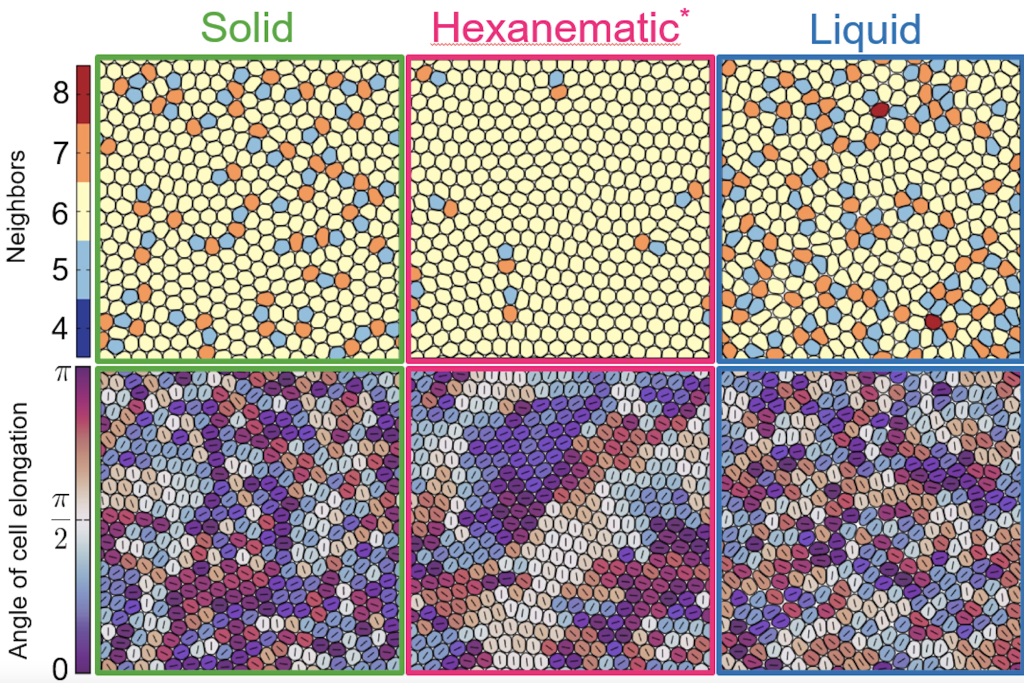
En el estado sólido se observó que la dinámica celular está arrestada, no hay defectos y tampoco orden.
Al acercarse a la transición entre sólido y líquido, motivados por fricción celular, se observa un ordenamiento nemático, en el que las células se alinean en una misma dirección, y surgen los defectos +1/2 y -1/2. También se aprecia un segundo tipo de ordenamiento, el hexático, en el que el sistema tiende a una organización hexagonal. Este también presenta defectos topológicos denominados pares de disclinaciones 57 o dislocaciones.

Luego, en la fase líquida, surgieron más defectos disclinaciones, y desapareció el orden nemático.
“La formación de un orden hexanemático en el área de transición entre los dos estados, se explica porque para poder deformarte y alinearte necesitas una especie de flujo, necesitas algo de células que se quieran mover, entonces requieres una alta propulsión y poca fricción. Pero para extender este orden a un mayor número de células, necesitas fricción. Luego, se necesita la cantidad ideal de fricción. Al tratar de cuantificar este orden, que se da en la zona de transición, notamos que aumenta la incidencia de defectos de packing, propios del orden hexático. Al graficar la probabilidad de encontrar en el mismo lugar defectos hexáticos de estructura 5-7 con defectos nemático , encontramos que esta es significativamente más alta para los defectos de tipo +1/2.Esto se debe a que la estructura 5 -7 naturalmente acomoda la formación de este defecto +1/2 mientras que la naturaleza del defecto -1/2 no lo hace. Entonces naturalmente el tejido trata de incorporar, combinar estos dos defectos juntos. Entonces, la pregunta que nos surge es si es realmente el orden orientacional o es quizás un defecto de packing que coinciden entre esos dos los que producen esta zona que favorece la extrusión de las células muertas”, plantea el investigador.

Los patrones espaciotemporales en sistemas multicelulares son importantes para comprender la dinámica de los tejidos, por ejemplo, durante el desarrollo embrionario y las enfermedades. Aquí, se utilizó un modelo de campo multifásico para estudiar numéricamente el comportamiento de una monocapa casi confluente de células deformables con fricción intercelular.
La variación de la fricción y la motilidad celular impulsa una transición sólido-líquido, y cerca del límite de transición, se encuentra la aparición de un orden nemático local de deformación celular impulsado por flujos celulares que se alinean con el cizallamiento. La fricción intercelular contribuye a la viscosidad de la monocapa, lo que aumenta significativamente la correlación espacial en el flujo y, concomitantemente, el grado del orden nemático.
“También, mostramos que el orden hexático y nemático local están estrechamente acoplados y proponemos un modelo mecánico-geométrico para la colocalización de defectos nemáticos y 5 a 7 pares de disclinación, que son los defectos estructurales en la fase hexática. Dichos defectos topológicos coinciden con regiones de alta superposición entre células, lo que sugiere que pueden mediar en la extrusión celular de la monocapa, como se encontró experimentalmente. Nuestros resultados delinean una base mecánica para la reciente observación del orden nemático y hexático en colectivos multicelulares en experimentos y simulaciones y señalan una vía genérica para acoplar efectos topológicos y físicos en estos sistemas“, concluye el investigador.


